
Endometriosi e dolore pelvico miofasciale: quali opportunità per le terapie manuali?
Dott. Giacomo Mamberto
- -
- - News
L’endometriosi è un disturbo cronico-infiammatorio, a tratti invalidante, che può colpire le donne in età riproduttiva ed associarsi ad infertilità. Si stima che attualmente, in Italia, le donne affette da endometriosi ammontino a circa 3 milioni, mentre spostando lo sguardo su una scala più globale, le statistiche riporterebbero il coinvolgimento di 1 donna su 10 (Nnoaham KE et al 2011).
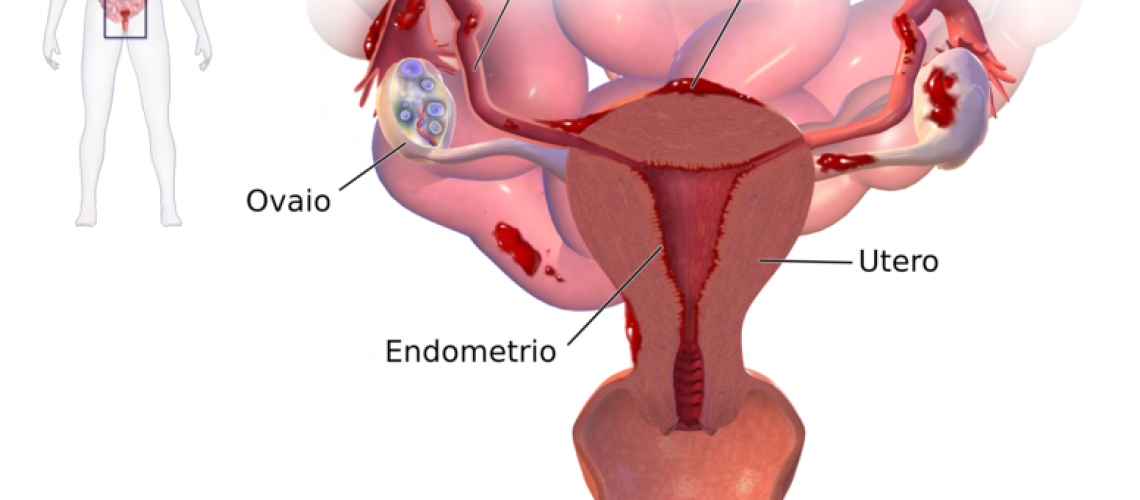
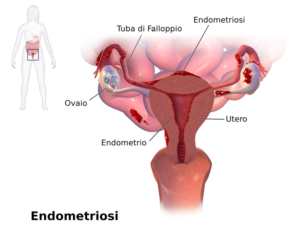
Clinicamente il disturbo può presentarsi con un vasto repertorio sintomatologico, sempre e comunque associato al dolore: dismenorrea (dolori associati al ciclo mestruale), dischezia e disuria (defecazione/minzione difficoltosa e dolorosa) sono sintomi frequenti. Il segno patognomico per eccellenza, invece, consiste nell’inconsueta e non fisiologica crescita di tessuto endometriale al di fuori della propria sede anatomica, l’utero.
In caso di endometriosi, infatti, il tessuto endometriale può migrare ed infiltrarsi in molteplici aree, fra cui intestino, vescica, tasca rettovaginale, ovaie, tube di falloppio, legamenti utero-sacrali, intestino, barriera addominale ed ureteri (Kwok H et al. 2020; Vagholkar K & Vagholkar S, 2019), assumendo la forma di lesioni pelviche estrogeno-dipendenti, resistenti al progesterone e dotate di una propria vascolarizzazione ed innervazione (Asante A & Taylor RN 2011; Greaves E et al. 2014). Tutte le aree di impiantamento, sotto spinta ormonale, saranno dunque indotte ad ispessirsi, sfaldarsi e sanguinare, mentre loro mancata espulsione porterà alla formazione di cisti, aderenze e tessuto cicatriziale.
La distribuzione di queste lesioni, in particolare delle lesioni peritoneali profonde (DIE), sembra essere associata ai pattern specifici di flusso dei liquidi peritoneali ed alla caratteristica morfologia della cavità pelvica (Kwok H et al. 2020, Abbott JA et al. 2003).
Endometriosi e dolore
Il 60% delle donne con diagnosi di endometriosi riferisce dolore pelvico cronico (CPP) ed è stato osservato come questi soggetti hanno una probabilità 13 volte più alta di provare dolore addominale in confronto a soggetti sani (Ballard et al., 2008). Diversi autori, fra cui Jaiswal U et al. (2020), hanno riscontrato all’interno di campioni di liquido peritoneale prelevati in donne affette da endometriosi, un’elevata presenza di citochine e fattori di crescita caratteristici (FGF2, CSF3, CSF2, CCL2 e IL1RN), i quali sembrerebbero contribuire alla patogenesi del disturbo ed essere considerati veri e propri marker diagnostici. Attualmente, i clinici sono soliti ricondurre il quadro algico del disturbo alle tipiche lesioni endometriosiche, orientando le strategie terapeutiche verso una rimozione chirurgica dei focolai e ad una somministrazione preventiva di ormoni (Fauconnier A & Chapron C, 2005). Nonostante questa pratica diffusa, precedenti studi hanno dimostrato che né l’estensione, né l’ubicazione delle lesioni siano correlabili agli indici di gravità e localizzazione del dolore pelvico (As-Sanie S et al., 2012; Bajaj P et al., 2003; Stratton P et al., 2015).
In effetti, in alcuni casi (20-28%), viene denunciata una ripresentazione dei sintomi anche in fase post-chirurgica e nonostante l’assenza di nuovi focolai (Vercellini P et al 2009; Sutton CJ et al 1994; Abbott J et al 2004). Tale evidenza ha portato i ricercatori ad esplorare aspetti neuropatologici inerenti pattern di modificazione neuroplastica tipici del dolore cronico, la comunicazione bidirezionale centro-periferia, la resting state functional connectivity (Magdalena A et al. 2019, As-Sanie S et al., 2012; As-Sanie S et al., 2016) e ad approfondire tematiche quali l’infiammazione, infiammazione neurogena, neuroangiogenesi, sensibilizzazione periferica e centrale (Maddern J et al., 2020), allodinia ed iperalgesia.
Ad esempio, Magdalena A et al. (2019), hanno ipotizzato e riscontrato come in questi soggetti subentri un’aumentata connettività a riposo fra le aree appartenenti all’elaborazione del dolore somato-sensoriale con regioni deputate all’elaborazione cognitiva ed emotiva.
Inoltre sono state sottolineate comorbilità con altri disturbi, fra cui la sindrome del colon irritabile e la sindrome della vescica iperattiva, un aspetto che ha indicato come le vie nervose comuni di colon, vescica e tratto riproduttivo femminile, possano innescare una sensibilizzazione organo-incrociata (cross-organ sensitization) (Maddern J, et al. 2020).
Endometriosi e dolore miofasciale: un’opportunità per le terapie manuali
Mediante uno studio trasversale e l’approfondimento dei rapporti fra disfunzionalità miofasciale, sensibilizzazione e dolore pelvico cronico, i ricercatori Phan VT et al. (2020), hanno deciso di aggiungere un tassello in più nell’approccio terapeutico manuale per l’endometriosi. Nelle donne affette da questo disturbo, infatti, un reperto semeiotico emergente è la riproducibilità dei sintomi mediante palpazione dei tessuti molli della pelvi. Nello studio sono state coinvolte trenta donne affette da endometriosi e dolore pelvico cronico associato. Le pazienti sono state successivamente sottoposte ad un approfondito esame ginecologico, addomino-pelvico e muscolo-scheletrico generalizzato, svelando caratteristiche interessanti sulla clinica del disturbo. Innanzitutto, è emersa una comune presenza di spasmi muscolari localizzati nelle strutture del pavimento pelvico. La palpazione manuale di questi elementi, infatti, è stata in grado di evocare dolore pelvico acuto focale (67%) o diffuso/non localizzato (33%) ed ha evidenziato che il 77% dei soggetti presentava spasmi muscolari in almeno 4 dei 6 muscoli del pavimento pelvico considerati. L’esame neuro-muscolo-scheletrico ha inoltre evidenziato come la maggior parte delle donne presenti disfunzioni miofasciali diffuse, con punti trigger papabili in 2/3 del corpo.
Gli autori hanno riportato che il 47% delle donne presenti punti trigger miofasciali in 26 differenti regioni corporee (un aspetto che ricorda i vecchi criteri di identificazione dei pazienti fibromialgici), con una sensibilizzazione diffusa sul segmento spinale (57%), segmento toracico (70%), segmento lombo-sacrale e pelvico (60%) e porzione sacroiliaca (30%). Non sono mancati reperti di sensibilizzazione del tratto cervico-spinale e riferimenti a dolore oro-facciale (70%) e mal di testa ricorrente (77%). Complessivamente, il 53% delle donne ha presentato una riduzione della soglia dolorifica su tutti i legamenti interspinosi (stimolo digitopressorio).
Questi reperti sembrano suggerire che nelle donne affette da endometriosi, i parametri di sensibilizzazione e disfunzione miofasciale si estendano ben oltre la semplice regione pelvica.
Secondo gli autori, la ragione di tale fenomeno potrebbe essere spiegato alla luce dei meccanismi di convergenza viscero-somatica, dei pattern di dolore riferito ed alla modificazione della connettività funzionale centrale. Inoltre, secondo i ricercatori, sarebbe lecito ipotizzare che gli spasmi muscolari localizzati nei tessuti molli del pavimento pelvico, attraverso precisi meccanismi di convergenza viscero-somatica, possano comportarsi come fattori d’innesco e perpetuazione della sensibilizzazione.
Come precedentemente supposto da altri colleghi, le strutture somatiche innervate da un segmento spinale correlato a patologia viscerale, possono facilmente presentare allodinia, iperalgesia e punti trigger miofasciali associati (Stratton P et al., 2015); questo, in quanto l’input nocivo può estendersi in senso metamerico e longitudinale lungo il midollo, coinvolgendo i circuiti associati al sistema somatico e portando a sensibilizzazione locale o diffusa (Aredo JV et al., 2017).
Gli autori sembrano dunque essersi avvicinati a conclusioni simili ad Aredo JV et al. (2017), Stratton P et al. (2015), Jarrell J (2011), Weiss PM (2012), Neville CE et al. (2013) che già in precedenza avevano esplorato le correlazioni fra disfunzionalità miofasciale, sensibilizzazione e dolore pelvico cronico.
Le terapie manuali sembrano dunque rivelarsi un possibile approccio integrabile alle comuni strategie di intervento all’endometriosi e come previa alterativa alle inoculazioni di tossina botulinica, strategia terapeutica invasiva utilizzata solitamente per le distonie focali e per le condizioni di iperattivazione neuro-muscolare (Abbott JA, 2006).
Il focus sul sistema linfatico e respirazione
Come precedentemente descritto, la distribuzione delle lesioni (in particolare DIE), sembra essere associata alla presenza di citochine, fattori di crescita e correlarsi ai pattern di flusso dei fluidi peritoneali ed alla morfologia della cavità pelvica. Anche le componenti cellulari presenti nei fluidi peritoneali sembrano esperire un proprio effetto in corso di endometriosi:
- Linfochine: coinvolte nei processi di infertilità associata all’endometriosi;
- Macrofagi: coinvolti nella sorveglianza immunitaria della cavità peritoneale, i quali sono spinti a differenziarsi e proliferare in presenza di citochine, TNF-a, Interleuchine e M-CSF (Weinberg JB et al.1991)
- Angiogenici, VEGF e fattori di crescita: i quali possono contribuire allo sviluppo di un sistema vascolare utile al mantenimento delle lesioni endometriosiche (Oosterlynck DJ, 1993);
- Prostaglandine: implicate anch’esse nell’infertilità nei pazienti con endometriosi, inducenti costrizioni venose dell’utero ed azioni sulla muscolatura liscia delle tube;
- Cellule mesoteliali: implicate nell’azione infiammatoria (Rong R et al., 2002).
Sembra pertanto corretto ipotizzare come una presenza continua e ripetitiva di queste componenti, all’interno dei fluidi peritoneali, possa giocare un ruolo eziopatogenico sul dolore e sull’insediamento dei focolai.
Negli ultimi anni, è aumentato l’interesse per gli approcci focalizzati sul sistema linfatico e della sua funzione in stati patologici quali tumori, malattie infiammatorie e metaboliche (Sarfarazi A et al., 2019).
Probabilmente, agire sul drenaggio linfatico della cavità peritoneale potrebbe esperire contributi terapeutici per fronteggiare l’endometriosi.
La cavità peritoneale è uno spazio rivestito da una membrana fasciale che circonda gli organi interni e contiene approssimativamente 100 ml di fluido sieroso (fluido peritoneale). Sono stati identificati stomi linfatici in varie aree del peritoneo, tra cui il rivestimento omentale (parete addominale anteriore), il mesentere, le regioni pelviche, ovariche e le regioni muscolari, periferiche e centrali-tendinee, del diaframma (Sarfarazi A et al. 2019).
Al suo interno sono presenti due tipi di aggregati linfatici: i “milky-spot” (piccole strutture linfatiche di 0.1-2.0 mm presenti soprattutto a livello del grande omento) e gruppi linfonodali associati al grasso (FALC), ricchi di macrofagi con attività fagocitica (Cruz-migoni et al., 2016). I macrofagi all’interno dei milky-spot e FALC possono fagocitare particelle e agenti patogeni presenti nella cavità peritoneale (Cruz-migoni et al., 2016) e sono quindi coinvolti nella risoluzione dell’infiammazione e dell’infezione peritoneale (Bin WZ et al., 2010).
La respirazione sembra essere uno dei fattori che può maggiormente influenzare l’assorbimento linfatico sottodiaframmatico (Sarfarazi A et al. 2019): i linfatici nel diaframma, infatti, formano un sistema specializzato che drena i fluidi dalla cavità peritoneale verso il sistema vascolare (Abu-Hijleh MF et al.1995). Durante l’espirazione la muscolatura diaframmatica si rilassa e, separandosi, induce un’apertura valvolare tale da consentire l’accesso linfatico agli stomi (Mactier e Khanna, 1989).
Anche l’aumento dei volumi del fluido intraperitoneale, la pressione idrostatica e la peristalsi intestinale possono incentivare l’assorbimento delle macromolecole dalla cavità peritoneale (Mactier RA & Khanna R, 1989), mentre la postura eretta riduce la velocità di clearance. Insieme con i linfatici diaframmatici, i linfatici parasternali rappresentano un’altra via di drenaggio della linfa peritoneale, confluente nei linfonodi mediastinici, nel dotto linfatico destro, nel dotto toracico sinistro ed infine nel sistema venoso.
Da un punto di vista osteopatico e terapico-manuale, focalizzarsi sull’assenza di restrizioni in ciascuna delle strutture elencate, potrebbe rivelarsi una corretta strategia d’intervento integrata.
Management osteopatico dell’endometriosi
Per citare le parole dell’osteopata Waugh Maadi Dalgliesh, “la gestione del dolore pelvico cronico (CPP) richiede un approccio multidisciplinare” (Waugh, Maadi Dalgliesh. 2019). Pertanto, con questa indicazione, gli osteopati dovrebbero essere ben preparati nella gestione del CPP, riconoscendone gli aspetti emotivi, psicologici e strutturali annessi (Engeler et al., 2013), e senza mai dimenticare lo spirito di collaborazione con gli altri professionisti della salute.
Come riportano Heinking KP & Kappler RE (2011), la diagnosi ed il trattamento manipolativo osteopatico (OMT) possono essere utili nel contesto del dolore pelvico, questo grazie al ripristino della corretta biomeccanica pelvica, la normalizzazione del sistema nervoso autonomo, la riduzione dello stato doloroso ed il miglioramento dei parametri circolatori/omeostatici.
Au contraire secondo la review del 2016 di Ruffini N et al. (2016), nonostante gli effetti positivi riportati in vari studi, il numero di ricerche di settore è ancora troppo esiguo e caratterizzato da un’elevata eterogeneità e notevoli rischi di bias. Pertanto, oggigiorno, il trattamento manipolativo osteopatico (OMT) può essere considerato efficace solo su alcune problematiche ostetrico-ginecologiche (es. mal di schiena gravidanza-correlato) e non su tutte le altre tipologie di disturbi d’ambito.
Probabilmente, i dati emergenti sul rapporto endometriosi-sistema miofasciale-sensibilizzazione e le considerazioni linfatiche sull’endometriosi, potrebbero apportare un contributo aggiuntivo per nuovi razionali d’intervento osteopatico.
Attualmente, in letteratura, è possibile trovare diversi riferimenti sul management osteopatico dell’endometriosi (es. Daraï C et al., 2015; Goyal K et al., 2017; Schneider-Milo U, 2011; Sillem M et al., 2016; Tettambel M, 2005) in cui vengono suggeriti interventi di check-up completo per tutto il corpo con un focus specifico su bacino e pavimento pelvico.
In questi lavori, è altresì possibile scorgere riferimenti a tecniche di tipo viscerale e/o pelviche mio-fasciali (es. mobilizzazione di utero, colon, giunzione gastro-esofagea e pelvic lift), così come tecniche indirette, manipolazioni manuali e trattamento di disfunzioni muscolo-scheletriche localizzate su colonna lombare, diaframma, articolazioni sacroiliache, occipite, sacro e core link durale. Non mancano suggerimenti di interventi sulle articolazioni temporo-mandibolari e rachide cervicale, un dettaglio che richiama inevitabilmente alle osservazioni di Phan VT et al. (2020).
Gli osteopati Moloney S et al (2019), in una loro recente pubblicazione, aggiungono dettagli sulla funzione della sinfisi pubica, essendo quest’area un importante sito di attacco per il sistema mio-fasciale pelvico (m. pubococcigeo, iliococcigeo, puborettale e levator ani), per il m. retto dell’addome, il m. pettineo ed il m. otturatore interno.
Infine, coerentemente ai concetti di olismo e globalità corporea, è opportuno riportare le considerazioni di Bordoni B (2020). L’autore, seguendo la scia di alcuni principi della tradizione osteopatica e unendo questi ultimi alle recenti osservazioni della ricerca medica, invita a non dimenticare i fenomeni di sinergia funzionale del diaframma pelvico con il resto dei diaframmi corporei (toracico inferiore, toracico superiore, tentoriale, linguale): un corretto bilanciamento delle sopracitate strutture anatomiche, potrebbe infatti garantire un’importante azione benefica sulla circolazione dei fluidi corporei (es. sangue e linfa) e sulla salute generale dell’individuo.
Bibliografia:
Abbott JA, et al. The effects and effectiveness of laparoscopic excision of endometriosis: a prospective study with 2-5 year follow-up. Hum Reprod. 2003;18(9):1922–7
Abbott JA, Jarvis SK, Lyons SD, Thomson A, Vancaille TG. Botulinum toxin type A for chronic pain and pelvic floor spasm in women: a randomized controlled trial. Obstet Gynecol. 2006; 108(4):915–923.
Abbott, J., Hawe, J., Hunter, D., Holmes, M., Finn, P., and Garry, R. (2004). Laparoscopic excision of endometriosis: a randomized, placebo-controlled trial. Fertil. Steril. 82, 878–884.
Abu-Hijleh, Marwan f., Omar a. Habbal, and Satei t. Moqattash. “The role of the diaphragm in lymphatic absorption from the peritoneal cavity.” Journal of anatomy 186.Pt 3 (1995): 453
Ali Sarfarazi, Given Lee, S. Ali Mirjalili, Anthony R.J. Phillips, John A. Windsor Natalie L. Trevaskisc Therapeutic delivery to the peritoneal lymphatics: Current understanding, potential treatment benefits and future prospects. International Journal of Pharmaceutics 567 (2019) 118456
Aredo JV, Heyrana KJ, Karp BI, Shah JP, Stratton P. Relating chronic pelvic pain and endometriosis to signs of sensitization and myofascial pain and dysfunction. Seminars in Reproductive Medicine (2017);35: 88-97.
Arendt-Nielsen L and Yarnitsky D. Experimental and clinical applications of quantitative sensory testing applied to skin, muscles and viscera. Journal of Pain (2009);10: 556-572.
Asante A, Taylor RN. Endometriosis: the role of neuroangiogenesis. Annu Rev Physiol 2011;73:163–182
As-Sanie S, Harris RE, Napadow V, Kim J, Neshewat G, Kairys A, Williams D, Clauw DJ, Schmidt-Wilcke T. Changes in regional gray matter volume in women with chronic pelvic pain: a voxel-based morphometry study. Pain (2012);153: 1006-1014.
As-Sanie S, Kim J, Schmidt-Wilcke T, Sundgren PC, Clauw DJ, Napadow V, Harris RE. Functional connectivity is associated with altered brain chemistry in women with endometriosis associated chronic pelvic pain. Journal of Pain (2016);17: 1-13.
Bajaj, Prem, et al. “Endometriosis is associated with central sensitization: a psychophysical controlled study.” The Journal of Pain 4.7 (2003): 372-380.
Ballard, K. D., Seaman, H. E., De Vries, C. S., and Wright, J. T. (2008). Can symptomatology help in the diagnosis of endometriosis? Findings from a national case-control study–Part 1. BJOG 115, 1382–1391. doi: 10.1111/j.1471-0528.2008.01878.x
Bin, Wang Z, Li, M., Li, J.C., 2010. Recent advances in the research of lymphatic stomata. Anat. Rec. 293 (5), 754–761
Bordoni B. The Five Diaphragms in Osteopathic Manipulative Medicine: Myofascial Relationships, Part 1. (April 23, 2020) Cureus 12(4): e7794. doi:10.7759/cureus.7794
Chapron C, Santulli P, de Ziegler D, Noel JC, Anaf V, Streuli I, Foulot H, Souza C, Borghese B. Ovarian endometrioma: severe pelvic pain is associated with deeply infiltrating endometriosis. Human Reproduction (2012);27: 702-711.
Cruz-migoni, S., Caamaño, J., Coles, M.C., Brendolan, A., Cruz-migoni, S., Caamaño, J., 2016. Fat-associated lymphoid clusters in inflammation and immunity. Front. Immunol. 7, 1– 7.
Daraï, C., Deboute, O., Zacharopoulou, C., Laas, E., Canlorbe, G., Belghiti, J., Daraï, E. (2015). Impact of osteopathic manipulative therapy on quality of life of patients with deep infiltrating endometriosis with colorectal involvement: results of a pilot study. European Journal of Obstetrics & Gynecology and Reproductive Biology, 188, 70–73.
Engeler, D. S., Baranowski, A. P., Dinis-Oliveira, P., Elneil, S., Hughes, J., Messelink, E. J., … Williams, A. C. (2013). The 2013 EAU Guidelines on Chronic Pelvic Pain: Is Management of Chronic Pelvic Pain a Habit, a Philosophy, or a Science? 10 Years of Development. European Urology, 64(3), 431–439
Fauconnier A and Chapron C. Endometriosis and pelvic pain: epidemiological evidence of the relationship and implications. Human Reproduction Update (2005);11: 595-606.
Goyal, Kanu, et al. “The effectiveness of osteopathic manipulative treatment in an abnormal uterine bleeding related pain and health related quality of life (HR-QoL)–A case report.” Journal of bodywork and movement therapies 21.3 (2017): 569-573.
Greaves E, Collins F, Esnal-Zufiaurre A, Giakoumelou S, Horne AW, Saunders PT. Estrogen receptor (ER) agonists differentially regulate neuroangiogenesis in peritoneal endometriosis via the repellent factor SLIT3. Endocrinology 2014a;155:4015–4026.
Heinking KP, Kappler RE. Pelvis and sacrum. In: Chila A, executive ed. Foundations of Osteopathic Medicine. 3rd ed. Lippincott Williams & Wilkins; 2011:575-601
Jaiswal, Urja, et al. “Cytokine and growth factor profile in endometriosis: a multiplex analysis of peritoneal fluid to assess diagnostic utility.” Gynecological Endocrinology (2020): 1-5.
Jarrell, J. Endometriosis and Abdominal Myofascial Pain in Adults and Adolescents. Curr Pain Headache Rep 15, 368 (2011).
Kwok, Hungling, et al. “Lesion distribution characteristics of deep infiltrating endometriosis with ovarian endometrioma: an observational clinical study.” BMC Women’s Health 20 (2020): 1-7.
Mactier, R.A., Khanna, R., 1989. Peritoneal cavity lymphatics. Perit. Dial. 4, 48.
Maddern J, Grundy L, Castro J and Brierley SM (2020) Pain in Endometriosis. Front. Cell. Neurosci. 14:590823. doi: 10.3389/fncel.2020.590823
Magdalena A. Ferdek, Joukje M. Oosterman, Agnieszka K. Adamczyk, Mieke van Aken, Kelly J. Woudsma, Bernard W.M.M. Peeters, Annemiek Nap, Miroslaw Wyczesany, Clementina M. van Rijn. Effective Connectivity of Beta Oscillations in Endometriosis-Related Chronic Pain During rest and Pain-Related Mental Imagery. The Journal of Pain : Official Journal of the American Pain Society, 30 May 2019
Moloney, Sean, Joel Talsma, and Stacey Pierce-Talsma. “Osteopathic Manipulative Medicine Considerations in Pelvic Pain.” The Journal of the American Osteopathic Association 119.11 (2019): e42-e43.
Neville, Cynthia E., et al. “A preliminary report of musculoskeletal dysfunction in female chronic pelvic pain: a blinded study of examination findings.” Obstetrical & Gynecological Survey 68.6 (2013): 435-437.
Nnoaham, K. E., Hummelshoj, L., Webster, P., D’hooghe, T., De Cicco Nardone, F., De Cicco Nardone, C., et al. (2011). Impact of endometriosis on quality of life and work productivity: a multicenter study across ten countries. Fertil. Steril. 96:e368.
Oosterlynck DJ, C Meuleman, M Waer, PR Koninckx, and M Vandeputte . Immunosuppressive activity of peritoneal fluid in women with endometriosis Obstetrics & Gynecology 1993;82:206-212 .
Orr N, Wahl K, Joannou A, Hartmann D, Valle L, Yong P, International Society for the Study of Women’s Sexual Health’s Special Interest Group on Sexual P. Deep Dyspareunia: Review of Pathophysiology and Proposed Future Research Priorities. Sexual Medicine Reviews (2020);8: 3-17.
Parungo, Cherie P., et al. “Lymphatic drainage of the peritoneal space: a pattern dependent on bowel lymphatics.” Annals of surgical oncology 14.2 (2007): 286-298.
Phan VT, Stratton P, Tandon HK, Sinaii N, Aredo JV, Karp BI, Merideth MA, Shah JP. Widespread myofascial dysfunction and sensitization in women with endometriosisassociated chronic pelvic pain: A cross-sectional study. Eur J Pain. 2020 Dec 16.
Rong R, Ramachandran S, Santanam N, Murphy AA, Parthasarathy S. Induction of monocyte chemotactic protein-1 in peritoneal mesothelial and endometrial cells by oxidized low-density lipoprotein and peritoneal fluid from women with endometriosis. Fertil Steril. 2002 Oct;78(4):843-8.
Ruffini, Nuria, et al. “Osteopathic manipulative treatment in gynecology and obstetrics: a systematic review.” Complementary therapies in medicine 26 (2016): 72-78.
Sarfarazi, Ali, et al. “Therapeutic delivery to the peritoneal lymphatics: Current understanding, potential treatment benefits and future prospects.” International journal of pharmaceutics 567 (2019): 118456.
Schneider-Milo, U. (2011). The effectiveness of osteopathic treatment in women with endometriosis-related pain. Danube University Krems. MSc (Osteopathy) Thesis.
Sillem M, Juhasz-Böss I, Klausmeier I, Mechsner S, Siedentopf F, Solomayer E. Osteopathy for Endometriosis and Chronic Pelvic Pain – a Pilot Study. Geburtshilfe Frauenheilkd. 2016;76(9):960-963. doi:10.1055/s-0042-111010
Stratton P, Khachikyan I, Sinaii N, Ortiz R, Shah J. Association of chronic pelvic pain and endometriosis with signs of sensitization and myofascial pain. Obstet Gynecol. 2015 Mar;125(3):719-28.
Sutton, C. J., Ewen, S. P., Whitelaw, N., and Haines, P. (1994). Prospective, randomized, double-blind, controlled trial of laser laparoscopy in the treatment of pelvic pain associated with minimal, mild, and moderate endometriosis. Fertil. Steril. 62, 696–700.
Tettambel, Melicien A. “An osteopathic approach to treating women with chronic pelvic pain.” The Journal of the American Osteopathic Association 105.suppl_4 (2005): S20-S22.
Vagholkar, Ketan, and Suvarna Vagholkar. “Abdominal Wall Endometrioma: A Diagnostic Enigma—A Case Report and Review of the Literature.” Case reports in obstetrics and gynecology 2019 (2019).
Vercellini P, Crosignani PG, Abbiati A, Somigliana E, Vigano P, Fedele L. The effect of surgery for symptomatic endometriosis: the other side of the story. Human Reproduction Update (2009);15: 177-188.
Waugh, Maadi Dalgliesh.Women’s experiences of osteopathic care whilst living with endometriosis. MS thesis. 2019
Weinberg JB, AF Haney, FJ Xu and S Ramakrishnan. Peritoneal fluid and plasma levels of human macrophage colony- stimulating factor in relation to peritoneal fluid macrophage content Department of Medicine and Obstetrics, VA Medical Center, Durham, NCVolume 78, Issue 2, pp. 513-516, 07/15/1991
Weiss, Patrice M., Jennifer Rich, and Eric Swisher. “Pelvic floor spasm: the missing link in chronic pelvic pain.” Contemporary OB/GYN (2012).

Dott. GIACOMOMAMBERTO
- D.O. MROI
- Perfezionato in Posturologia
- Perfezionato in Medicina Tradizionale Cinese
Contatti
- Centro So-Wen Via Marostica 38 20146 Milano
- 351 9010927
-
Riceve su Appuntamento:
Lunedì con orario 09.30 - 18.30

Dott. GIACOMOMAMBERTO
- D.O. MROI
- Perfezionato in Posturologia
- Perfezionato in Medicina Tradizionale Cinese
Contatti
-
Studio Medico
Via Giovanni Pascoli 37
20133 Milano
- 02 400 981 80
-
Riceve su Appuntamento:
Lunedì con orario 09.30 - 18.30
osteopatiamilano.org all rights reserved